Bildgebende Methoden
Label-freie digitale Pathologie
Gewebe- und Zelldiagnostik
Eine der am häufigsten genutzten diagnostischen Methoden ist die Untersuchung von Gewebedünnschnitten. Hierzu werden Gewebeproben entnommen und mit einem Mikrotom in dünne Schnitte (1-10 µm) geteilt. In der klassischen Histopathologie, die in dem oberen Teil der Abbildung dargestellt ist, wird die Probe gefärbt (H&E) und von einem Pathologen oder einer Pathologin unter dem Mikroskop bewertet. Die resultierende Diagnose ist der Goldstandard in der Klinik. Analog zu Gewebeproben werden in den Kliniken aber auch Zellproben analysiert, die häufig aus nicht- oder gering-invasiv gewonnenen Körperflüssigkeiten wie Urin von Patienten gewonnen werden. Bei Blasenkrebs beispielsweise ist der Goldstandard für die Diagnose die invasive Zystoskopie (Gewebediagnostik), die Komplikationen verursachen kann. Neben dieser Methode wird die Urinzytologie, d.h. die mikroskopische Auswertung von H&E-gefärbten Zellen aus dem Urin, als begleitende Methode eingesetzt. Wir haben einen alternativen, Label-freien Ansatz etabliert. Diesen Ansatz nennen wir Label-freie digitale Pathologie (Kallenbach-Thieltges et al Journal of Biophotonics 2013).
Label-freie digitale Pathologie
Hierzu werden mit IR-/Raman-Imaging ortsaufgelöst Vibrationsspektren aufgenommen. Die Vibrationsspektren repräsentieren dabei die chemische Zusammensetzung des zugrundeliegenden Gewebes oder der Zellen. Wir untersuchen humanes Gewebe oder Zellen mit IR-/Raman-Imaging. Dabei werden die Spektren als integraler Marker für den biochemischen Status (Proteom, Genom, Transkriptom, Lipidom und Metabolom) des Gewebes oder der Zellen zum Zeitpunkt der Entnahme der Probe genutzt. Die Spektren bilden Muster, die charakteristisch für den molekularen Zustand sind, ähnlich wie ein Fingerabdruck charakteristisch für einen Menschen ist.
Die Abbildung zeigt den Workflow der klassischen Histopathologie und die Klassifikation von Gewebe durch IR-/Raman-Imaging. Im IR-/Raman-Imaging werden die Proben nicht gefärbt, sondern ortsaufgelöst Spektren aufgenommen. Durch Vergleich mit einer spektralen Datenbank ist eine Label-freie, automatisierte Klassifikation von Gewebe und Zellen möglich. Im Vergleich zum Goldstandard in der Klinik, der Histopathologie, erreichen wir für verschiedene Gewebe und Zellen eine Sensitivität und Spezifität von über 95% (Kallenbach-Thieltges et al Journal of Biophotonics 2013).
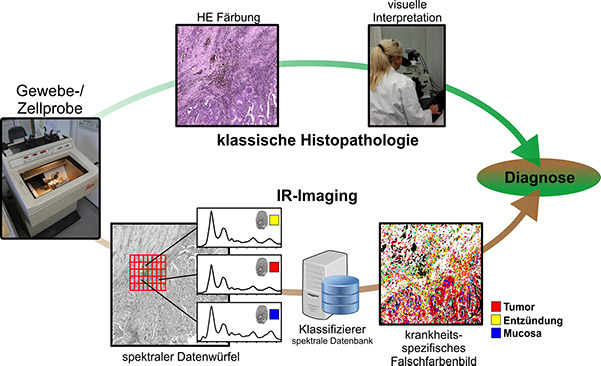
Abb. 1: Im oberen Verlauf ist die klassische Histopathologie gezeigt. Das Gewebe wird in dünne Schnitte zerteilt und angefärbt, um Gewebsstrukturen sichtbar zu machen. Anschließend wird das Gewebe durch visuelle Inspektion beurteilt. Als weiteres Werkzeugt ist im unteren Teil das Label-freie IR-/Raman-Imaging gezeigt. Hierbei wird der ungefärbte Gewebedünnschnitt automatisiert basierend auf ortsaufgelösten Spektren analysiert. Dies erlaubt mittels maschinellen Lernens eine Einordnung und Zuordnung des Gewebes, welche beobachterunabhängig erfolgt.
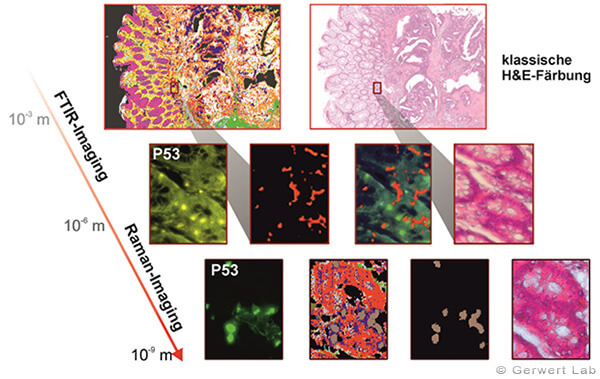
Abb. 2: Die Auflösung eines Mikroskops ist von der eingestrahlten Wellenlänge abhängig. Daher eignet sich IR-Imaging hervorragend für großflächige Gewebeanalysen, wenn es jedoch um die Betrachtung einzelner Zellen geht, muss auf eine höher auflösende Technik gewechselt werden, das Raman-Imaging.
Infrarot-Imaging zur Gewebediagnostik
Durchgeführt wird das IR-Imaging mit Infrarotmikroskopen, die spezielle FPA-Detektoren (focal plane array) mit 64×64 bzw. 128×128 Pixeln oder Mikrobolometer mit 480×480 Pixeln nutzen. Dies ermöglicht die simultane ortsaufgelöste Vermessung von großen Gewebeschnitten. Durch weitere technische Modifikationen kann so eine schnelle und kontinuierliche Datengewinnung erfolgen. Klassisch wurde die FTIR-Methodik (Fourier-Transform-Infrarot) verwendet, diese ist jedoch technisch bedingt sehr langsam für das Imaging. Inzwischen haben sich Quantenkaskadenlaser (QCL) etabliert, die ein IR-Imaging in wenigen Minuten anstatt vieler Stunden erlauben (Kuepper et al Scientific Reports 2018).
Raman-Imaging zur Gewebe- und Zelldiagnostik
Das Raman-Imaging wird mit konfokalen Mikroskopen in Kombination mit drei Lasern (532, 633 und 785 nm Wellenlänge), Spektrometern mit ultrahohem Durchsatz und rückseitengedünnten, deep depletion CCD-Detektoren durchgeführt. Dies ermöglicht die ortsaufgelöste Messung von Proben. Die herkömmliche Raman-Technik ist jedoch für die Bildgebung langsam. Daher wurden nichtlineare Raman-Methoden, einschließlich der kohärenten Anti-Stokes-Raman-Streuung (CARS) und der stimulierten Raman-Streuung (SRS), mit durchstimmbaren Pikosekunden-Lasern etabliert. Dies ermöglicht eine schnelle Bildgebung mit einer Geschwindigkeit bis zur Videorate anstelle von mehreren Stunden (Aljakouch et al Analytical Chemistry 2019, Krauß et al Journal of Biophotonics 2018, Yosef et al Analytical Chemistry 2017, Petersen et al Analyst 2016).
Molekulare Fingerabdrücke für präzisere Diagnostik
Neben der medizinisch diagnostischen Anwendung kann FTIR-/Raman-Imaging aufgrund der robusten, ortsaufgelösten und beobachterunabhängigen Charakterisierung an unbehandelten Gewebeproben oder Zellen auch in der Biomarkersuche eingesetzt werden. Hierzu haben wir in ProDi ein einzigartiges Verfahren entwickelt, welches die ortsaufgelöste Gewebeerkennung des IR-Imagings nutzt, um mit einer Lasermikrodissektion (LMD) Proben für Omics-Techniken (z.B. Proteomik) zu sammeln. Dies erlaubt es, im Bereich der Biomarkersuche zum ersten Mal ortsaufgelöst an sehr präzise annotierten aber noch unbehandelten Proben zu arbeiten (Großerüschkamp et al Scientific Reports 2017).
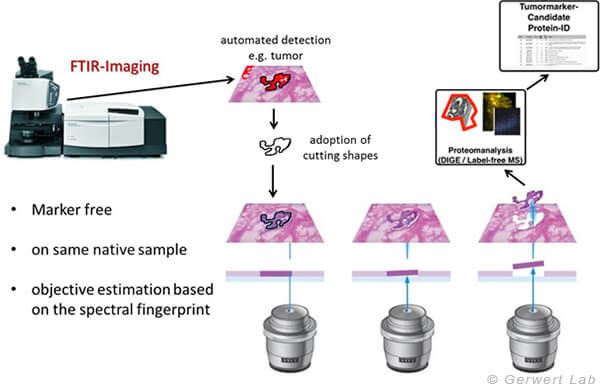
Abb. 3: Der Vorteil der hier beschriebenen Methoden ist, dass das Gewebe nicht verändert wird und so für andere Methoden, wie die Proteomik, unverändert zur Verfügung steht. Dies ist ein einzigartiger Vorteil in der Biomarkersuche. Die in ProDi entwickelte Methode erlaubt es so homogene Gewebebereiche durch Kombination der Label-freien digitalen Pathologie mit Lasermikrodissektion automatisiert zu sammeln
Presse
Presseinformationen
Pressespiegel
Drittmittelförderung

111.08.03.05-133974
Validierung und Standardisierung des Workflows zur Proteindiagnostik
FP-0259 CDE
Verifizierung von neuen molekularen Markern für die Frühdiagnose von Lungentumoren zum Nutzen der nachgehenden Vorsorge
Marker-gestützte Nachsorge von Patienten mit nicht-muskelinvasiven low/intermediate-risk Harnblasentumoren (UroFollow)

PURE – Protein Research Unit Ruhr within Europe
233-1.08.03.03-031-68079
Validierung Marker-freier Imaging Verfahren und neu identifizierter Biomarker unter Nutzung des PURE-Konsortium
FP-339
Entwicklung proteinanalytischer Verfahren zur Identifikation von Kandidatenmarkern zur Unterstützung der (Früh-)Diagnose asbestassoziierter Lungen- und Pleuratumoren