Analyse von Körperflüssigkeiten
Minimalinvasive Diagnostik
Immuno-Infrarot-Sensor
Neben Gewebe-basierten bildgebenden Ansätzen zur Identifikation neuer Biomarkerkandidaten und zur präzisen (Früh-)Diagnostik onkologischer Erkrankungen werden im Kompetenzbereich Biospektroskopie insbesondere auch humane Körperflüssigkeiten wie Blutplasma und Rückenmarksflüssigkeit (Liquor) zur (Früh-)Diagnostik neurodegenerativer Erkrankungen. Die Diagnostik an Körperflüssigkeiten hat den großen Vorteil, dass insbesondere Blut minimal-invasiv und kostengünstig im Rahmen der Routinediagnostik sowohl in Kliniken als auch in Hausarztpraxen gewonnen wird.
Biomarker-Detektion für neurodegenerative Erkrankungen
Heutzutage weitläufig eingesetzte quantitative Methoden zur Detektion spezifischer Biomarkerkandidaten in Körperflüssigkeiten, wie z. B. Enzyme-linked immune-sorbent assays (ELISA) oder massenspektrometrische Techniken, haben sich bisher für Bluttests bei neurodegenerativen Erkrankungen nicht durchsetzen können. Diese Techniken weisen entweder die Gesamtmenge eines Proteins unabhängig von dessen Faltung nach oder selektiv nur eine einzelne Sekundärstruktur. Da neurodegenerative Erkrankungen meist mit der Fehlfaltung von Proteinen assoziiert sind, ist eine Messung der gesamten Verteilung der Sekundärstrukturen der krankheitsassoziierten Proteine, wie z. B. dem Amyloid-β- (Aβ)-Peptid bei Alzheimer-Erkrankungen (Morbus Alzheimer), wünschenswert.
Infrarot-Spektroskopie gibt Aufschluss über Fehlfaltungen
Wir haben eine Methode entwickelt, die alle Aβ-Peptide detektiert und zeitgleich, mit Hilfe infrarot (IR)-spektroskopischer Messverfahren, ihre Sekundärstrukturverteilung analysiert. Ein erhöhter Anteil an β-Faltblatt-reichen Strukturen in der Gesamtverteilung aller Aβ-Peptide ist assoziiert mit der Alzheimer-Erkrankung. Mittels der IR-Spektroskopie werden Informationen über die Sekundärstrukturverteilung von Proteinen erheblich schneller und einfacher gewonnen als mit Röntgenkristallographie oder Kernspin Resonanz (NMR)-Spektroskopie.
Die charakteristischste und größte Absorptionsbande von Proteinen ist die Amid-I-Bande, die durch Absorption des Peptidrückgrads versursacht wird und zwischen 1700 und 1600 cm-1 liegt. Die genaue Position der Amid-I-Bande ist hierbei abhängig von der jeweiligen Sekundärstruktur (Nabers et al Journal of Biophotonics 2016). Den größten Anteil der Absorption der Amid-I-Bande hat die C=O Streckschwingung der Peptidbindung. Die Unterschiede in den Wasserstoffbrückenbindungen zwischen C=O und NH Gruppen und den Kopplungen der C=O Schwingungen führen zu unterschiedlichen Schwingungsenergien und so zu unterschiedlichen Absorptionsfrequenzen der Amid-I-Banden. Die Sekundärstruktur β-Sheet, in der die mit Alzheimer assoziierten Aß-Fibrillen hauptsächlich vorliegen, ruft eine Amid-I-Bande mit einem Maximum bei 1630 cm-1 hervor. Im Gegensatz dazu absorbieren α-helikale und ungeordnete Sekundärstrukturen von Proteinen im Bereich von 1655 – 1645 cm-1. Da gesunde Menschen einen hohen Anteil an ungeordneten / α-helikalen Aβ-Peptiden besitzen, sind deren Proben anhand der Form der Amid-I-Bande von den Proben von Patienten mit Morbus Alzheimer zu unterscheiden. Damit das funktioniert, muss allerdings die gesamte Verteilung der Sekundärstrukturen aller Aβ-Peptide gemessen werden.
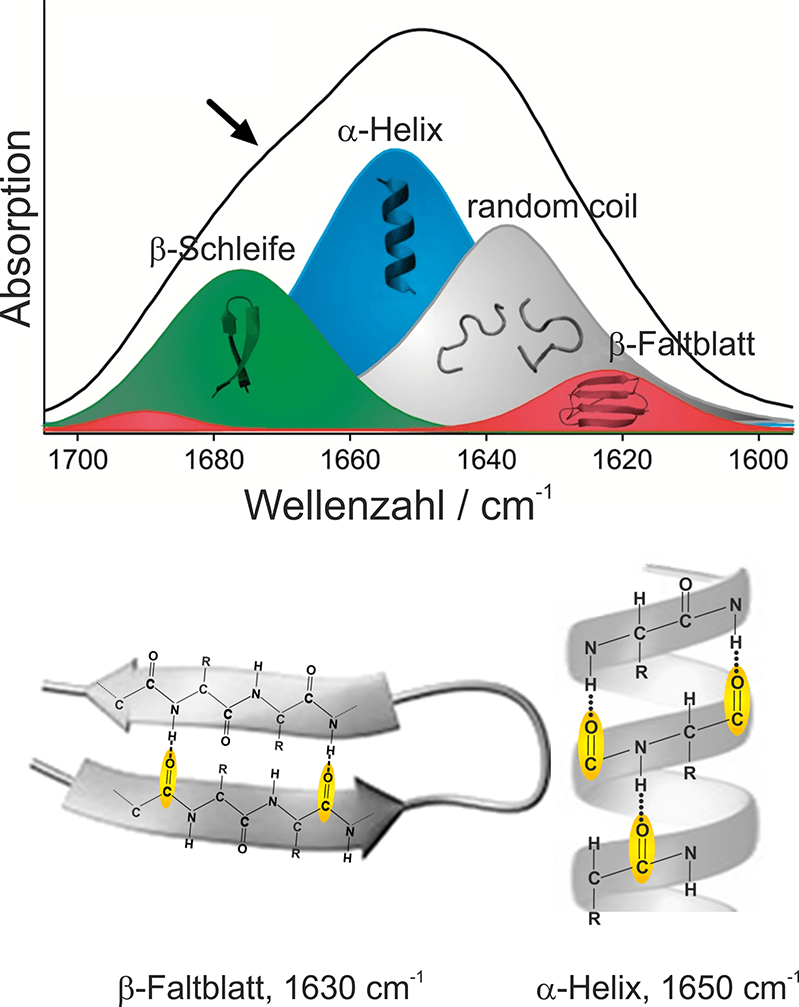
Abb. 1: Zuordnung von Sekundärstrukturelementen zu ihren spektroskopischen Eigenschaften

Abb. 2: Medienwechsel während der Herstellung von monoklonalen Antikörpern.
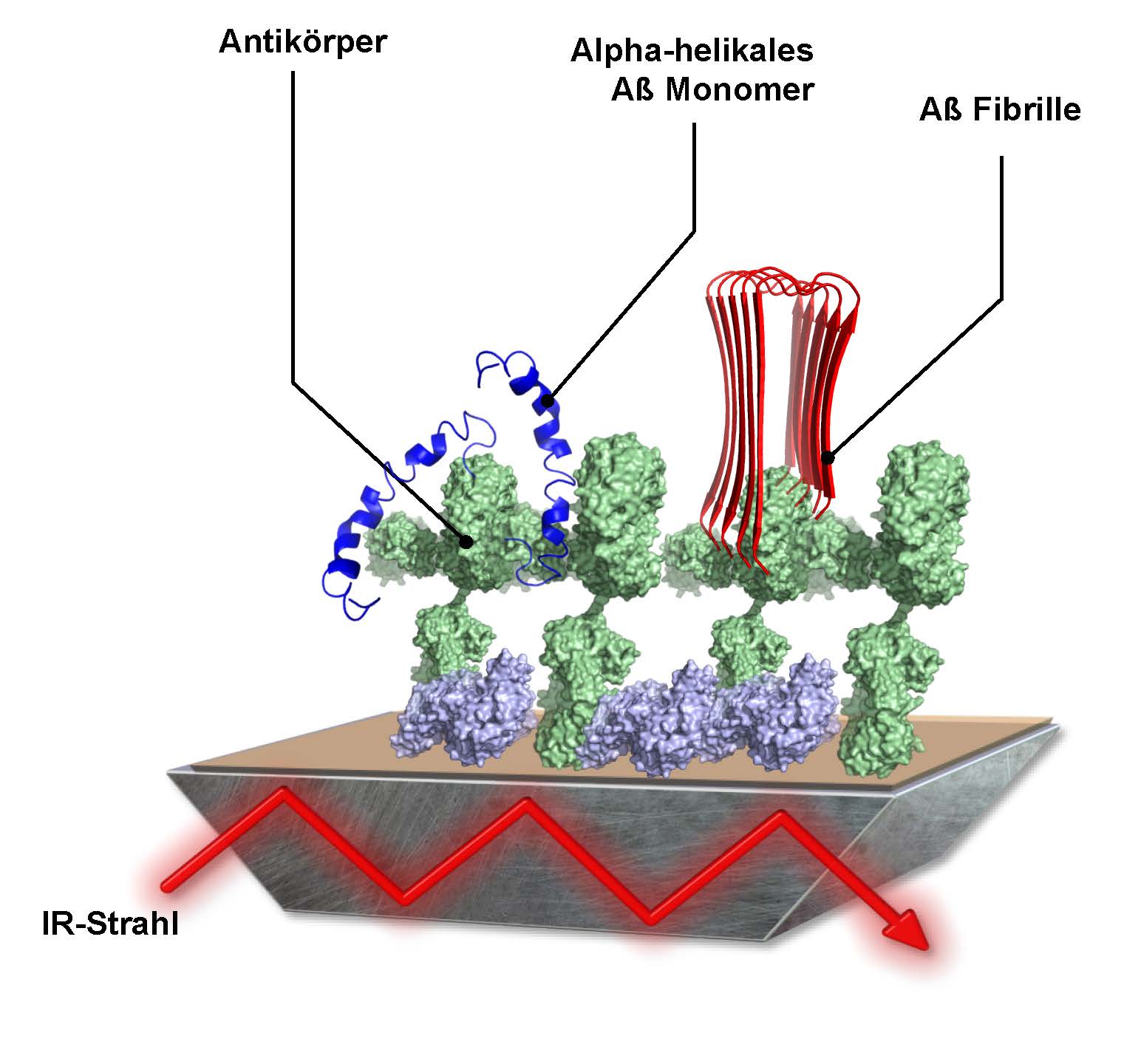
Abb. 3: Schematischer Aufbau des Immuno-Infrarot Sensors.
Immuno-Infrarot-Sensor zur Frühdiagnose von Morbus Alzheimer
Um die zeitgleiche Detektion und spektroskopische Analyse der Sekundärstruktur der Aβ-Peptide zu ermöglichen, haben wir unsere konventionellen spektroskopischen Methoden angepasst und einen Immuno-Infrarot-Sensor entwickelt. Herzstück dieses Sensors ist eine Antikörper-beschichtete Oberfläche des internen Reflexions-Elements (IRE) eines ATR (Abgeschwächte Totalreflektion)-Aufbaus. Bei dem ATR-Aufbau wird ein Infrarotstrahl durch das IRE geleitet (Nabers et al Journal of Biophotonics 2016). Der an der Oberfläche des IRE evaneszierende IR-Strahl interagiert mit den über spezifische Antiköper an dieser Oberfläche immobilisierten Proteinen. Dabei ist es entscheidend, dass der verwendete Antikörper parallel alle Konformationen des Proteins bindet und somit die Sekundärstrukturverteilung bestimmt werden kann.
Durch Differenzbildung der Spektren vor und nach der Bindung des Zielproteins wird die Sekundärstruktur-sensitive Amid-I-Bande des Proteinrückgrats des Zielproteins gemessen. Die detektierte Amid-I-Bande stellt ein integriertes Signal über alle gebundenen Protein-Konformationen dar. Je höher der Anteil an pathogenen Formen in der Gesamtverteilung ist, desto weiter verschiebt sich das Maximum der detektierten Amid-I-Bande zu niedrigeren Wellenzahlen. Die β-Faltblatt-reichen, toxischen Isoformen zeigen ein Maximum im Bereich um 1638 cm-1, wohingegen monomere, nicht-toxische Formen bei etwa 1652 cm-1 absorbieren. Unsere Studien haben ergeben, dass bei gesunden Probanden das spektroskopische Maximum der Amid-I-Bande oberhalb eines experimentell bestimmten Schwellbereichs um 1643 cm-1 liegt, während es bei Probanden mit Alzheimer-Erkrankung unterhalb dieses Schwellwertes liegt. In bisherigen Studien hat unser Immuno-Infrarot-Sensor bei Patienten, die später an Alzheimer erkrankt sind, die richtige Tendenz bereits bis zu 8 Jahre vor klinischer Manifestation von Symptomen vorhergesagt (Nabers et al EMBO Molecular Medicine 2018. Durch den Einsatz neuartiger Quantenkaskadenlaser (QCL) als Infrarotlichtquelle bietet sich nun die Möglichkeit einer Optimierung und Miniaturisierung des Messaufbaus. Dies ist der erste Schritt in der Entwicklung eines kliniktauglichen Geräts.
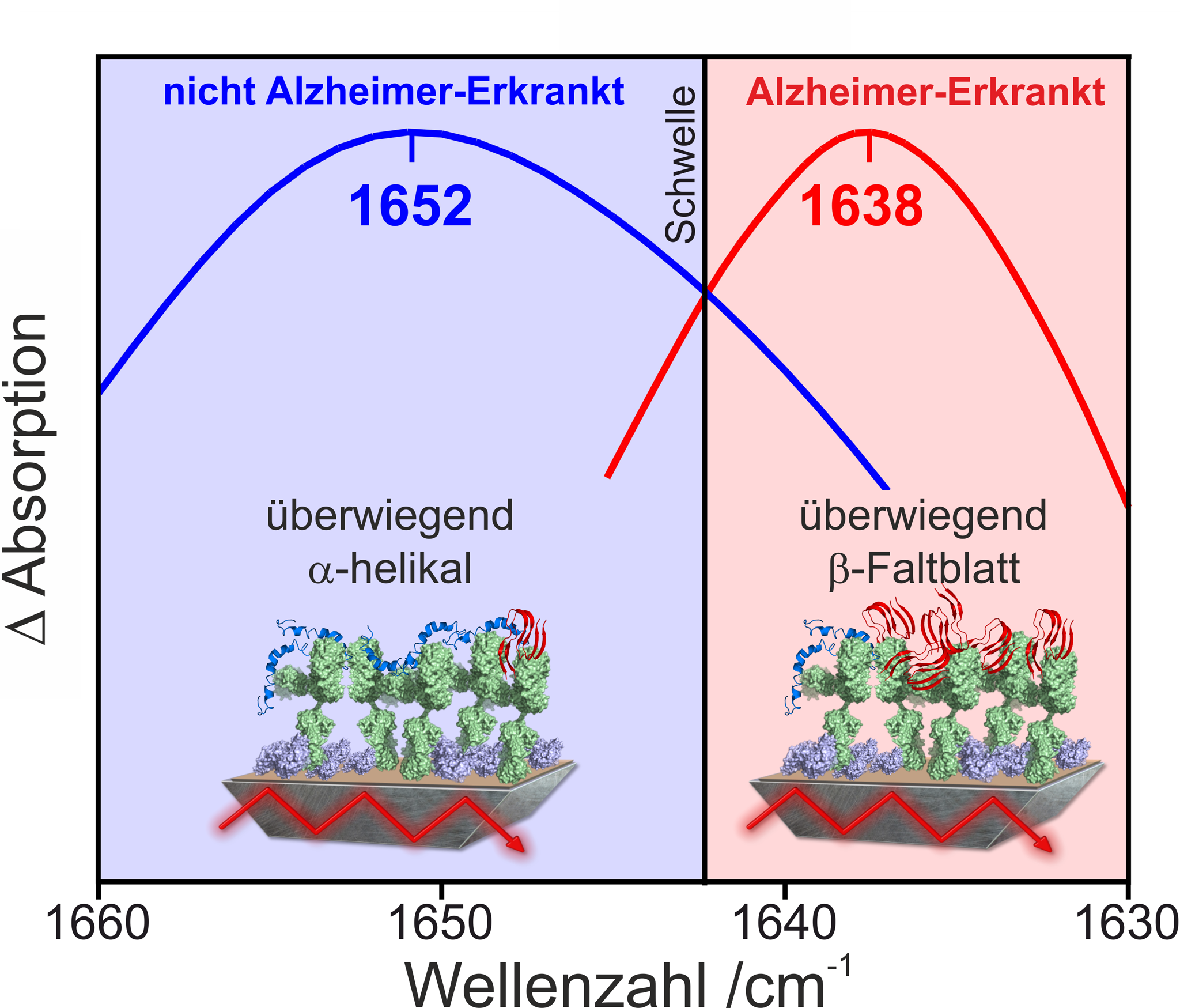
Abb. 4: Spektrale unterscheidung von Alzheimer erkrankten Patienten und Gesunden
Presse
Presseinformationen
Pressespiegel
Drittmittelförderung

111.08.03.05-133974
Validierung und Standardisierung des Workflows zur Proteindiagnostik

Correlation between Aβ42 decrease and misfolding in blood
PURE – Protein Research Unit Ruhr within Europe
Validierung Marker-freier Imaging Verfahren und neu identifizierter Biomarker unter Nutzung des PURE-Konsortium