Onkologische Erkrankungen
Personalisierte Diagnostik für optimale Therapieprädiktion
Im Kompetenzbereich Biospektroskopie werden u. a. neuartige vibrationsspektroskopische Methoden entwickelt, um Krebserkrankungen präziser und früher zu diagnostizieren. Dafür untersuchen wir Gewebedünnschnitte und Zellsedimente mittels spektroskopischer bildgebender Verfahren. Wir nennen diesen Ansatz Label-freie digitale Pathologie (Großerüschkamp, Gerwert GIT Laboratory Journal 2018).
Betrachten wir beispielsweise das kolorektale Karzinom, so kann heute schon in fortgeschrittenen Stadien eine Immuntherapie eingesetzt werden. Hierdurch werden die Krebszellen gezielt für das körpereigene Immunsystem markiert, so dass unser eigener Körper sie abbauen kann. Allerdings ist diese Therapieform nicht für jeden Tumorpatienten wirkungsvoll. So kann es heute noch passieren, dass ein Patient diese Therapie erhält, jedoch keinen Nutzen von ihr hat, während ein anderer sie nicht erhält, dem sie nutzen würde. Grund hierfür ist, dass die heute zur Verfügung stehenden diagnostischen Werkzeuge z. T. noch nicht geeignet sind, alle individuellen Charakteristika der Patienten vollständig zu erfassen. Nur eine präzise, personalisierte Diagnostik kann die beste Therapie für jeden Patienten voraussagen. Jeder Mensch ist einzigartig.

Abb. 1: Klassische Histologie – Gewebedünnschnitte werden gefärbt und durch einen erfahrenen Pathologen mit einem Lichtmikroskop begutachtet.
Neuartige diagnostische Methoden durch Spektroskopie
Im Kompetenzbereich Biospektroskopie identifizieren und validieren wir charakteristische vibrationsspektroskopische Biomarker, um die Diagnose und Einstufung onkologischer Krankheitsbilder zu automatisieren. Ein Vibrationsspektrum stellt aufgrund seiner hohen Sensitivität und der kumulativen Erfassung aller enthaltenen Substanzen ein vollständiges biochemisches Abbild – gleich einem Fingerabdruck – der Gewebeprobe dar. Dabei erfolgt die Spektrenaufnahme in wenigen Sekunden, ohne die Probe anfärben oder Bestandteile chemisch markieren zu müssen (Kuepper et al Scientific Reports 2018).

Abb. 2: Forscherin an einem modernen IR-Imaging System. Auf dem Bildschirm ist die falschfarben Darstellung des Gewebes im IR-Imaging zu sehen.
Spektroskopie in der Krebsforschung
Hierzu führen wir Analysen von Gewebe und Körperflüssigkeiten durch. Gewebeproben werden mit IR- (InfraRot) und Raman-spektroskopischen Methoden analysiert. Es werden sowohl ortsaufgelöste mikrospektroskopische Ansätze als auch Punktmessungen mit Fasersonden durchgeführt. Die ortsaufgelöst gemessenen Spektren werden nach spektraler Ähnlichkeit gruppiert und für die Mikrospektroskopie als Falschfarbenbild dargestellt. Die höhere Ortsauflösung der Raman-Technik ermöglicht sogar die dreidimensionale Bildgebung intrazellulärer Komponenten an lebenden Zellen (Hammoud et al Scientific Reports 2018). Nach pathologischer Annotation werden Klassifikatoren trainiert, um in Zukunft ausschließlich anhand spektraler Signaturen Gewebe und pathologische Veränderungen automatisiert zu identifizieren und die Mediziner bei der Diagnostik zu unterstützen.
Diese automatisierte und probenschonende Methodik erlaubt selbst an kleinsten Biopsien eine gleichbleibend präzise Krebsdiagnostik, ohne die Probe für nachfolgende Untersuchungen, wie beispielsweise Proteomanalysen, zu zerstören (Großerüschkamp et al Scientific Reports 2017). Im Fokus der Forschung im Kompetenzbereich Biospektroskopie stehen dabei Darm-, Blasen- und thorakale Tumoren (z. B. Lungenkrebs). Hier ist es uns gelungen, selbst therapieentscheidende molekulare Veränderungen der Tumoren mit spektralen Fingerabdrücken zu korrelieren. Dies erlaubt eine schnelle, therapieentscheidende diagnostische Hilfestellung, die unabhängig von der Erfahrung eines Menschen mit gleichbleibender Genauigkeit Krebs diagnostizieren kann.
Die Wirkung von Medikamenten
Darüber hinaus ermöglicht unser Ansatz die Erforschung der Wirkmechanismen von Medikamenten. So können beispielsweise Krebsmedikamente in einzelnen Zellen verfolgt werden, wodurch wichtige Rückschlüsse auf deren Wirkungsweise gewonnen werden (Yosef et al Analyst 2018). Neben unserem diagnostischen Ansatz hilft dies in der pharmazeutischen Forschung, präzisere Wirkstoffe zu entwickeln. In Kombination mit einer präzisen Diagnostik erlaubt dies in Summe eine schonende und erfolgreiche Behandlung von Patienten (Aljakouch et al Analytical Chemistry 2019).
Arten der Krebserkrankungen
Darmkrebs (hier kolorektales Karzinom)
Kolorektale Karzinome (KRK) sind die dritthäufigste Krebsart und eine der häufigsten krebsbedingten Todesursachen weltweit. In den letzten Jahren basierten viele Verbesserungen in der Behandlung auf einem tieferen Verständnis der molekularen Heterogenität auf mehreren Ebenen, darunter Genomik, Epigenomik und Transkriptomik. Für manche Patienten können schon heute neuartige Medikamente angewendet werden, wie Pembrolizumab oder Nivolumab/Ipilimumab. Diese Methodik wird auch als Immuntherapie bezeichnet, da sie es für fortgeschrittene KRK (Stadium IV) erlaubt, Tumorzellen durch Antikörper für das körpereigene Immunsystem angreifbar zu machen. Diese schonende Therapie ist zwar sehr teuer, aber extrem wirksam; jedenfalls bei einem Teil der Patienten. Diese Patienten, die gut auf eine Immuntherapie ansprechen korrekt zu diagnostizieren, ist eines der Ziele in unserem Darmkrebsprojekt.
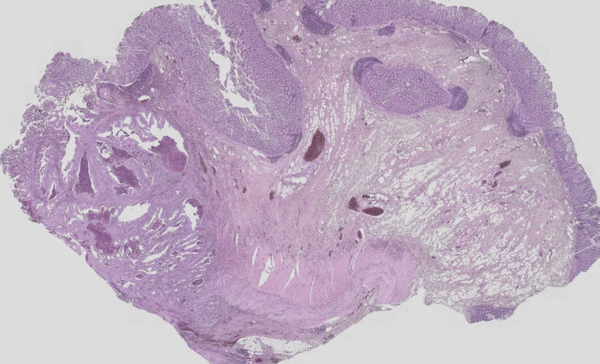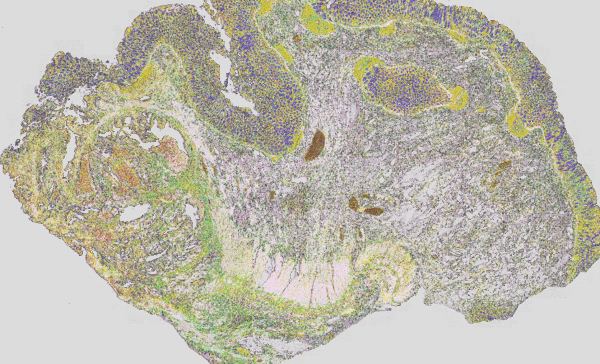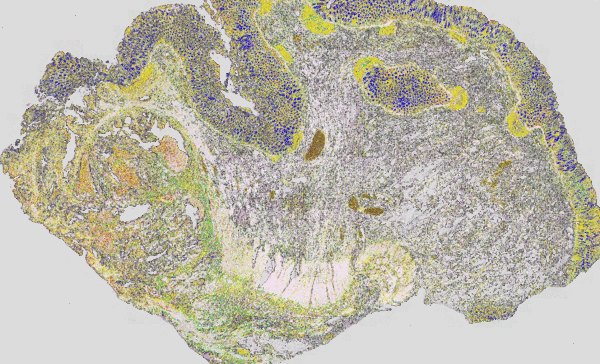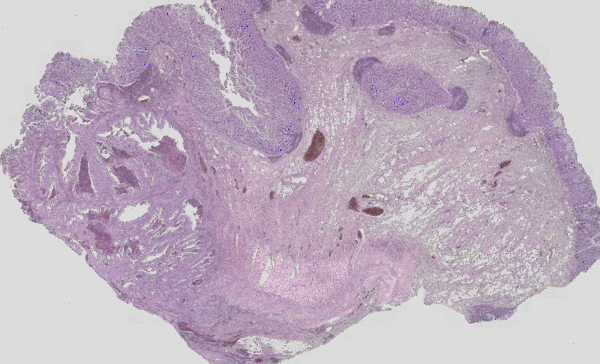
Abb. 3: Klassische H&E Färbung (rot-violette-blaue Färbung) eines Tumors überlagert mit dem IR-Imaging Falschfarbenbild. Links ist die Tumorläsion als unstrukturierter Bereich im H&E Bild gut zu erkenne, im IR-Imaging ist dieser Bereich ohne Vorkenntnisse des Nutzers automatisiert in rot Markiert worden. Die Struktur eines eher gesunden Darms ist auf der rechten Seite zu erkenn. Das IR-Imaging erlaubt die Analyse aller Gewebetypen.
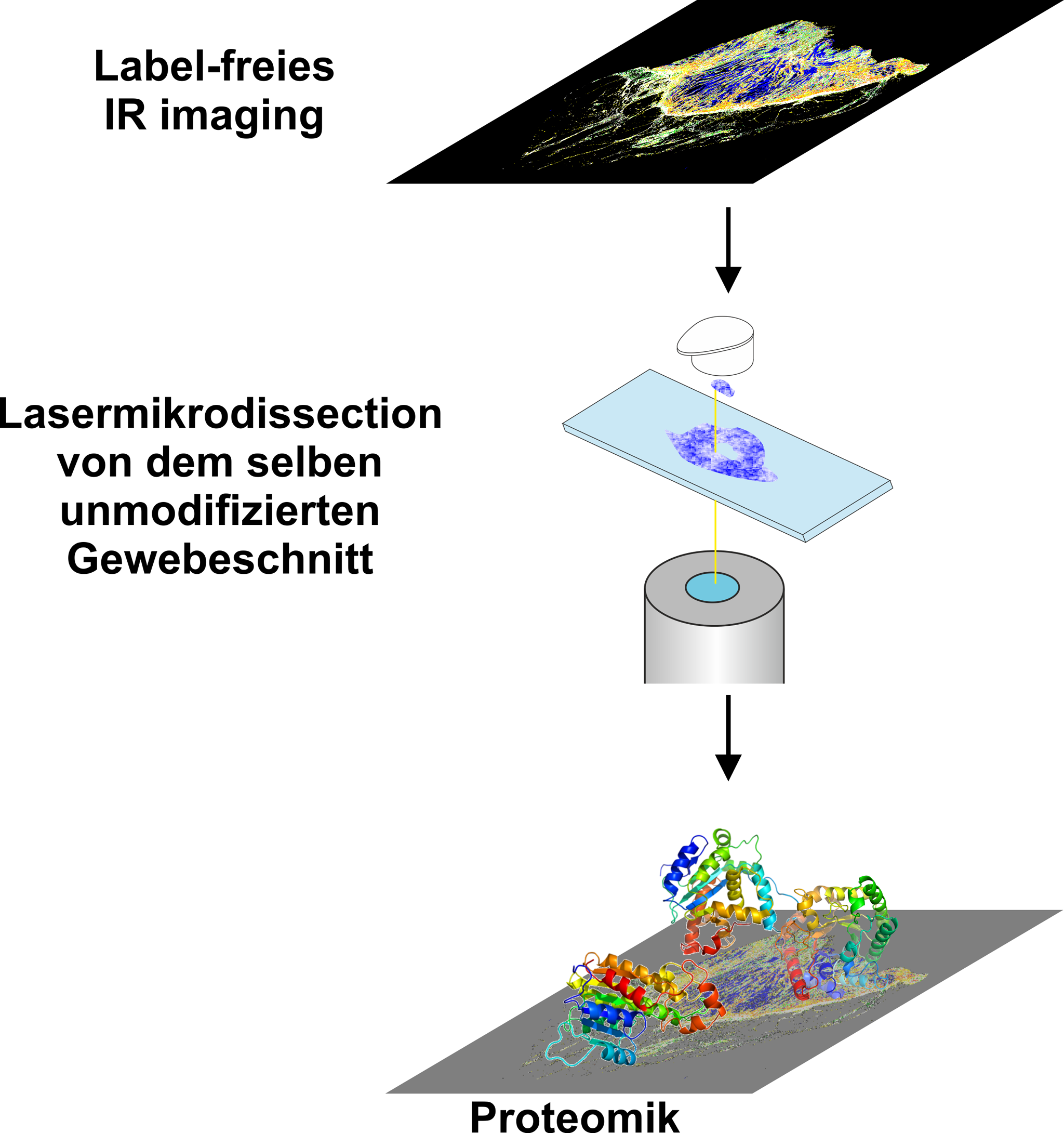
Abb. 4: Die Label-freie Erkennung durch das IR-Imaging erlaubt die präzise Selektion von Gewebebereichen für nachfolgende Untersuchungen, wie die Proteomik.
In Zusammenarbeit mit den Kliniken der Ruhr-Universität Bochum und den anderen Kompetenzbereichen untersuchen wir das kolorektale Karzinom (Kuepper et al Faraday Discussions 2016, Kallenbach-Thieltges et al Journal of Biophotonics 2013). Dazu haben wir eine spektrale Datenbank angelegt (Kuepper et al Scientific Reports 2018). Mit FTIR- und Raman-Imaging konnten wir eine Charakterisierung von Gewebedünnschnitten des Darms mit hoher Genauigkeit (>96 %) etablieren. Es können feinste Details, wie etwa die für eine Einstufung des Karzinoms wichtige muscularis mucosae, aufgelöst werden (Kuepper et al Scientific Reports 2018). Die nächsten Schritte in diesem Projekt konzentrieren sich auf die Validierung der Methodik anhand der Colopredict Plus 2.0 Registerstudie und der Abbildung therapieentscheidender molekularer Veränderungen. Das primäre Ziel ist eine Translation dieser innovativen Methodik in den klinischen Einsatz.
Blasenkrebs / Prostatakarzinom
Auch Blasenkrebs wird in Zusammenarbeit mit den Kliniken der Ruhr-Universität Bochum untersucht. Im laufenden Projekt wurde mit IR-Imaging die automatisierte Charakterisierung von Blasentumoren etabliert werden. Eine zentrale, weiterführende Fragestellung in der Diagnostik von Blasenkrebs ist die differentielle Fragestellung des Tumorgrades. Denn diese entscheidet über die Entnahme der Blase. Die Diagnostik von Blasenkrebs gestaltet sich mitunter schwierig, da eine Entzündung der Blase nur sehr schwer von einem high grade Karzinom (carcinoma in situ – CIS) zu unterscheiden ist. Durch Einsatz des IR-Imagings war es uns möglich, eine automatisierte Charakterisierung des Gewebes zu etablieren, die die differentielle Fragestellung des Tumorgrades beantworten kann. Diese sehr präzise und robuste Charakterisierung wird derzeit validiert. So können perspektivisch unnötige Resektionen der Blase und das damit verbunden Leid vermieden werden (Witzke et al The American Journal of Pathology 2019).
Durch Kombination mit Omics-Techniken soll ein tiefergehendes Verständnis der Biochemie von Blasentumoren gewonnen werden. Hier wurde bereits ein neuer Biomarker (AHNAK2) für die Diagnose von CIS in ProDi identifiziert (Witzke et al The American Journal of Pathology 2019).
Darüber hinaus entwickeln wir im Kompetenzbereich Biospektroskopie eine nicht-invasive Methode zur Früherkennung und Diagnostik von Blasenkrebs. Hierbei werden Raman-Techniken angewendet, um die Zellbestandteile des Urins zu charakterisieren (El-Mashtoly, Gerwert GIT Imaging & Microscopy 2019). Dieser Ansatz soll es perspektivisch erlauben, die Anzahl an Blasenspiegelungen zur verringern und so die Bereitschaft zur Vorsorge verbessern.
In den nächsten Jahren wird dieser Ansatz auf Prostatakarzinome erweitert. Hier ist die Bestimmung des Tumorgrades einer der therapieentscheidenden Faktoren und soll durch unseren innovativen Ansatz vereinfacht und verbessert werden.
Durch Kombination mit Omics-Techniken soll ein tiefergehendes Verständnis der Biochemie von Blasentumoren gewonnen werden. Hier wurde bereits ein neuer Biomarker (AHNAK2) für die Diagnose von CIS in ProDi identifiziert (Witzke et al The American Journal of Pathology 2019).
Darüber hinaus entwickeln wir im Kompetenzbereich Biospektroskopie eine nicht-invasive Methode zur Früherkennung und Diagnostik von Blasenkrebs. Hierbei werden Raman-Techniken angewendet, um die Zellbestandteile des Urins zu charakterisieren (El-Mashtoly, Gerwert GIT Imaging & Microscopy 2019). Dieser Ansatz soll es perspektivisch erlauben, die Anzahl an Blasenspiegelungen zur verringern und so die Bereitschaft zur Vorsorge verbessern.
In den nächsten Jahren wird dieser Ansatz auf Prostatakarzinome erweitert. Hier ist die Bestimmung des Tumorgrades einer der therapieentscheidenden Faktoren und soll durch unseren innovativen Ansatz vereinfacht und verbessert werden.
Thorakale Tumoren
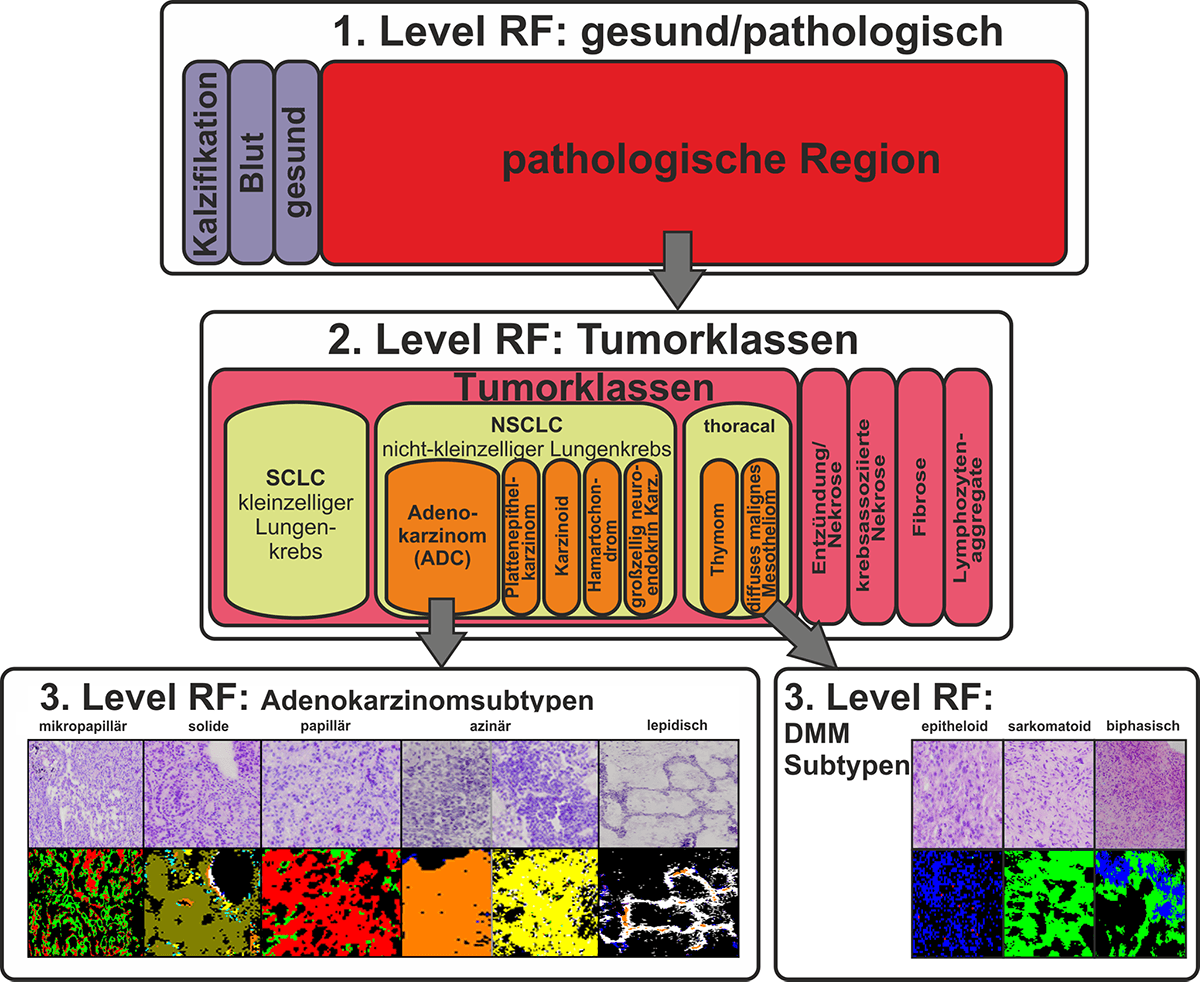
Lungenkrebs ist eine der Krebsarten mit der schlechtesten Prognose für erkrankte Patienten. Dies liegt zum einen an der hohen Komplexität der Erkrankung und zum anderen an der häufig sehr späten Diagnose eines Lungentumors. Ziel unserer Projekte ist es, diagnostische Marker zur Charakterisierung von Lungenkrebs zu finden. Mit FTIR-Imaging war es uns möglich, eine automatisierte Charakterisierung des Lungenkrebses und einwandernder Tumoren (z. B. Mesotheliome der Pleura) mit einer Genauigkeit > 94 % zu etablieren (Großerüschkamp et al Analyst 2015). Um den prognostischen Wert dieser Erkennung zu erhöhen, wurde diese um die Erkennung von Tumorsubtypen erweitert. So war es uns als weltweit erster Gruppe möglich, eine automatisierte Erkennung der Subtypen von Adenokarzinomen der Lunge an Gewebedünnschnitten zu etablieren. In absteigender Reihenfolge der Mortalität sind dies mikropapilläres, solides, papilläres, azinäres und lepidisches Karzinom. Bisher war die Zuordnung dieser Subtypen nur über komplizierte immunhistochemische Färbemethoden mit hoher Fehleranfälligkeit möglich.
Aufgrund der hohen Heterogenität von Lungentumoren ist gerade in dieser Entität die Gewinnung von biochemischen Informationen oder gar Biomarkerkandidaten sehr schwierig. Durch unseren Ansatz, der Kombination von FTIR-Imaging mit Lasermikrodissektion zur Probengewinnung für Omics-Techniken, werden wir Proben für die Analyse des Gewebes in bisher unerreichter Genauigkeit erhalten. Erste vielversprechende Experimente zeigen, dass dieser Ansatz eine sehr präzise, molekulare Charakterisierung des Gewebes erlaubt und neue Biomarkerkandidaten liefern kann (Großerüschkamp et al Scientific Reports 2017).
Companion Diagnostics von Wirkstoffen
Evaluation von gezielten Krebstherapien durch Raman-Mikroskopie
Die Bewertung der Wirksamkeit von Arzneimittelkandidaten in vitro in den frühen Phasen der Arzneimittelentwicklung ist von wesentlicher Bedeutung. Die derzeit verwendeten in vitro-Tests zur Überwachung der Medikamentenwirksamkeit werden häufig mit fluoreszenzmarkierten Medikamentenmolekülen durchgeführt. Trotz der hohen molekularen Spezifität, welche Fluoreszenzmoleküle bieten, sind diese häufig viel größer als die Wirkstoffmoleküle selbst und können die pharmazeutische Aktivität des Medikaments erheblich beeinflussen. Alternativ dazu haben wir eine markierungsfreie Methode entwickelt, bei der menschliche Zelllinien verwendet werden, die mit Arzneimittelkandidaten behandelt wurden. Sowohl die konventionelle Raman-Mikroskopie als auch die stimulierte Raman-Streuung (SRS) können als in-vitro-Screeningmethoden eingesetzt werden.
Um die Wirksamkeit von Medikamenten auf subzellulärer Ebene zu bestimmen, haben wir zunächst eine automatische Identifizierung von zellulären Organellen einschließlich des Zellkerns, des Nukleolus, der Lipidtropfen, des endoplasmatischen Retikulums, des Golgi-Apparats und der Mitochondrien etabliert. Die Raman-Mikroskopie wird auch zur Erkennung der zellulären Reaktion auf gezielte Krebstherapien, wie z.B. EGFR-Inhibitoren, eingesetzt. Beispielsweise kann der Einfluss bestimmter Treiberprotein-Mutationen, wie die des onkogenen K-Ras-Proteins oder des EGFR, untersucht werden. Darüber hinaus kann die räumliche Verteilung und der Metabolismus von Tyrosinkinase-Inhibitoren wie Erlotinib oder Neratinib in Krebszellen nachgewiesen werden. Somit bietet die Raman-Mikroskopie ein großes Potenzial für Pharmakodynamik- und Pharmakokinetik-Studien in Zellen.
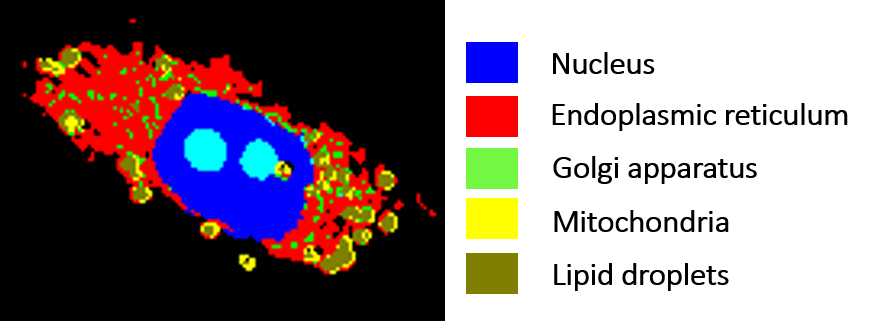
Abb. 6: Markierungsfreie Identifizierung von Zellorganellen.
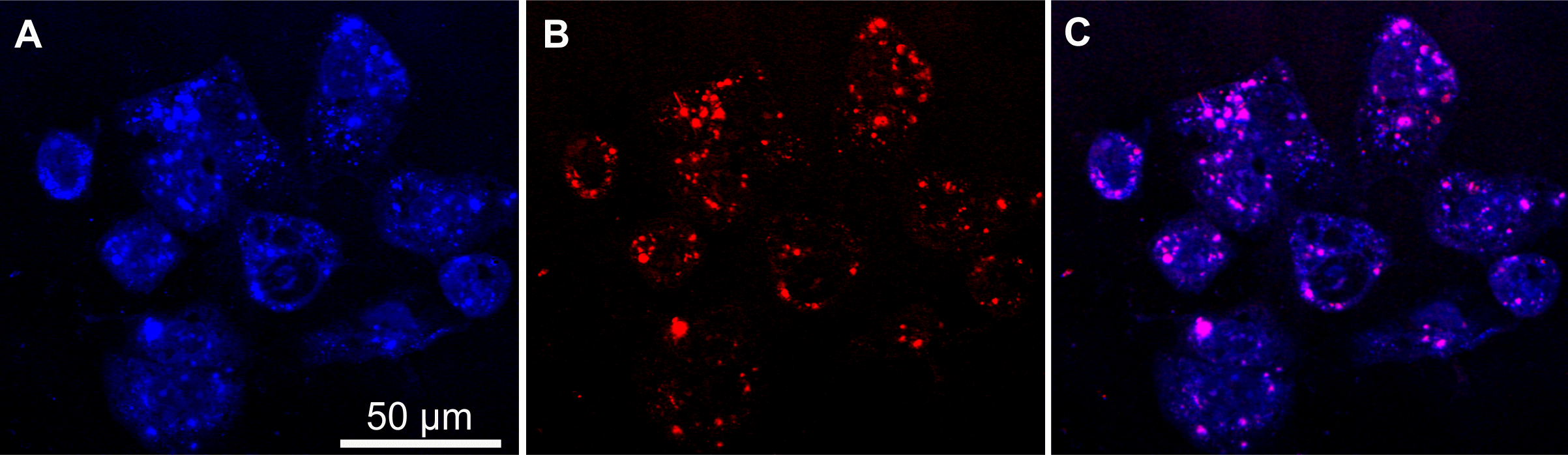
Abb. 7: SRS-Intensitäten von (A) der C-H-Streckschwingung, indikativ für Lipid und Proteine der Zellen und (B) C≡N Streckschwingung, Marker der Neratinib und (C) Überlagerung von (A) und (B).
Presse
Presseinformationen
Pressespiegel
Drittmittelförderung

111.08.03.05-133974
Validierung und Standardisierung des Workflows zur Proteindiagnostik


EFRE-Förderkennzeichen: EFRE-0802016
Aufbauhilfe für den Zusammenhalt und die Gebiete Europas im Rahmen des Recovery Assistance for Cohesion and the Territories of Europe (REACT-EU) – Projektaufruf „Digitalisierung in der klinischen Medizin und Gesundheitsforschung“
FP-0259 CDE
Verifizierung von neuen molekularen Markern für die Frühdiagnose von Lungentumoren zum Nutzen der nachgehenden Vorsorge
FP-0241 BC
Marker-gestützte Nachsorge von Patienten mit nicht-muskelinvasiven low/intermediate-risk Harnblasentumoren (UroFollow)

Label-free digital pathology and spatially resolved transcriptomics for the identification of novel biomarkers and therapeutic targets in inflammatory bowel diseases
131/1.08-031
PURE – Protein Research Unit Ruhr within Europe
Validierung Marker-freier Imaging Verfahren und neu identifizierter Biomarker unter Nutzung des PURE-Konsortium
FP-339
Entwicklung proteinanalytischer Verfahren zur Identifikation von Kandidatenmarkern zur Unterstützung der (Früh-)Diagnose asbestassoziierter Lungen- und Pleuratumoren
Schlüsselpublikationen
Großerüschkamp, Gerwert GIT Laboratory Journal 2018
Darmkrebs
Kuepper et al Scientific Reports 2018
Kuepper et al Faraday Discussions 2016
Kallenbach-Thieltges et al Journal of Biophotonics 2013
Lungenkrebs
Großerüschkamp et al Scientific Reports 2017
Großerüschkamp et al Analyst 2015
Blasenkrebs
Witzke et al The American Journal of Pathology 2019
Companion Diagnostics
Hammoud et al Scientific Reports 2018
Aljakouch et al Angewandte Chemie 2018
El-Mashtoly et al Analytical Chemistry 2015